
solución
(Gp:) 20°c
(Gp:) T
(Gp:) 40°c
(Gp:) 80°c
(Gp:) Q1
(Gp:) Q3
(Gp:) Q2

CAMBIOS DE FASE
FASE: Es estado de una sustancia que tiene constitución física homogénea y su composición química permanece inalterable.
En la naturaleza pueden existir como fase liquida, fase sólida, vapor.
CAMBIOS DE FASE: Es aquel fenómeno físico que consiste en el reordenamiento molecular, que experimenta una sustancia como consecuencia de la ganancia o perdida de calor bajo determinadas condiciones, de presión y temperatura.
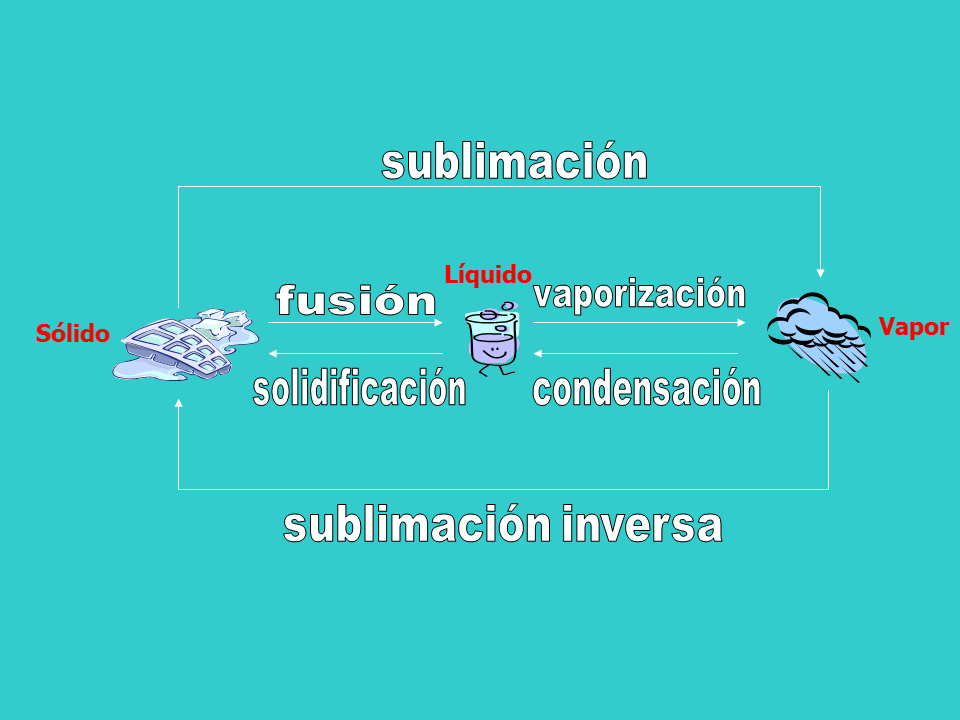
sublimación
sublimación inversa
fusión
vaporización
condensación
solidificación
Sólido
Vapor
Líquido

FUSIÓN: Es el cambio de la fase sólida ala fase liquida.
TEMPERATURA DE FUSIÓN (Tf): Es la temperatura alcanzada por un cuerpo en la cual está en condiciones de cambiar de la fase sólida a fase liquida. La temperatura de fusión depende de la presión ejercida sobre el cuerpo.
CALOR LATENTE: Es el calor por unidad de masa que se debe de entregar a una sustancia para que cambie de fase.
El calor latente representa la cantidad de calor que debe recibir 1 kg de una sustancia cuando se encuentra a su temperatura de fusión para pasar de la fase sólido a la fase liquido, para el hielo el calor latente de fusión es

SOLIDIFICACIÓN: Es el proceso inverso a la fusión es decir, es el cambio de fase liquida a fase sólida esto ocurre en las mismas condiciones de presión y temperatura de la fusión.
CALOR LATENTE DE SOLIDIFICACIÓN (Ls): Es la cantidad de calor que se debe extraer a cada unidad de masa de la sustancia para cambiar de fase liquida a fase sólida.

VAPORIZACIÓN: Se define como el proceso de cambio de fase liquida a vapor.
CALOR LATENTE DE VAPORIZACIÓN (Lv): Es el calor que se debe entregar a cada unidad de masa de la sustancia liquida.
El calor latente de vaporización de agua a una atm de presión es:

CONDENSACIÓN: Es el proceso inverso a la vaporización. Ocurre a la misma temperatura de ebullición.
CALOR LATENTE DE CONDENSACIÓN (Lc): Es la cantidad de calor que se debe quitar a 1gr de vapor de una sustancia para cambiarla a la fase liquida cuando se encuentra a su respectiva temperatura de condensación o vaporización.

CANTIDAD DE CALOR LATENTE: Es la cantidad de calor que recibe o pierde una sustancia durante el proceso de cambio de fase.
m = masa de cambio de fase
L = Lv (si se tiene vaporización o condensación)
L = Lf (si se tiene fusión o solidificación)

Se tiene 20gr de hielo a -10°c ¿Cuánto de calor es necesario entregar para convertir el hielo en vapor a temperatura de 150°C?
Ce hielo = 0.5cal/g°C
Ce vapor = 0.5cal/g°C
Ejemplo:

solución
(Gp:) -10°c
(Gp:) 0°c
(Gp:) 100°c
(Gp:) 150°c
(Gp:) Q1
(Gp:) Q2
(Gp:) Q3
(Gp:) Q4
(Gp:) Q5
(Gp:) M hielo = 20gr
Análisis de calor
Q1: calor sensible necesario para calentar el hielo desde -10°c hasta 0°c
Q1 = m hielo Ce hielo (0- (-10))
Q1 = (20)(0.5)(10)
Q1 = 100cal.
Q2: calor latente de fusión necesaria para derretir el hielo a 0°c (Lf=80cal/gr)
Q2 = mLf
Q2 = (20)(80)
Q2 = 1600cal

Q3 = calor sensible necesaria para calentar el agua desde 0°c hasta 100°c
Q3 = mCe(100-0)
Q3 = (20)(1)(100)
Q3 = 2000cal
Q4 = calor latente de vaporización necesaria para vaporizar todo el agua a 100°c (Lv=540cal/gr)
Q4 = mLv
Q4 = (20)(540)
Q4 = 10800cal
Q5 = calor sensible necesario para calentar el vapor desde 100°c hasta 150°c
Q5 = mCe (150-100)
Q5 = (20)(0.5)(50)
Q5 = 500cal
El calor necesario total será:
Q1+Q2+Q3+Q4+Q5=15000cal

Se mezclan 5gr de hielo a 0°C con 45gr de agua a 10°C ¿Qué cantidad de energía gana el hielo cuando el sistema se estabiliza?
Ejemplo:

solución
(Gp:) 0°c
(Gp:) T
(Gp:) 10°c
(Gp:) Q1
(Gp:) Q2
(Gp:) Q3

Cuando el sistema se estabiliza se cumple que:

Cuando la temperatura del equilibrio T=1°C, entonces la cantidad de calor que gana el hielo es:

MECANISMOS DE TRANSFERENCIA DECALOR
CONDUCCIÓN
CONVECCIÓN
RADIACIÓN
El calor se define como la forma de energía que se puede transferir en forma natural de un sistema a otro como resultado de la diferencia de temperatura.

37
(Gp:) Mecanismos de transmisón de calor
(Gp:) Conducción: transferencia de energía desde cada porción de materia a la materia adyacente por contacto directo, sin intercambio, mezcla o flujo de cualquier material.
(Gp:) Convección: transferencia de energía mediante la mezcla íntima de distintas partes del material: se produce mezclado e intercambio de materia.
(Gp:) Convección natural: el origen del mezclado es la diferencia de densidades que acarrea una diferencia de temperatura.
(Gp:) Convección forzada: la causa del mezclado es un agitador mecánico o una diferencia de presión (ventiladores, compresores…) impuesta externamente.
(Gp:) Radiación: transferencia de energía mediada por ondas electromagnéticas, emanadas por los cuerpos calientes y absorbidas por los cuerpos fríos.

38
sólidos
Interacción de partículas
gases
líquidos
Transferencia de calor por conducción
Vibración de
moléculas
Colisiones y
difusión de moléculas

39
Conducción
Ley de Fourier: determinación del flujo de calor
(Estado estacionario)
(Gp:) Calor difundido por unidad de tiempo
(Gp:) Conductividad térmica (W·m-1·grado -1): calor que atraviesa en la dirección x un espesor de 1 m del material como consecuencia de una diferencia de 1 grado entre los extremos opuestos
(Gp:) Superficie (m2): superficie a través de la cual tiene lugar la transmisión de calor
(Gp:) Gradiente de temperatura (grados/m): variación de la temperatura en la dirección indicada por x.
(Gp:) X

Ecuación para la conducción del calor
Que se conoce como ley de Fourier de conducción de calor. El calor es conducido en la dirección de la temperatura decreciente, y el gradiente de temperatura se vuelve negativo cuando la temperatura disminuye con x creciente.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |